Förkortad förskrivningsinformation
▼Detta läkemedel är föremål för utökad övervakning.
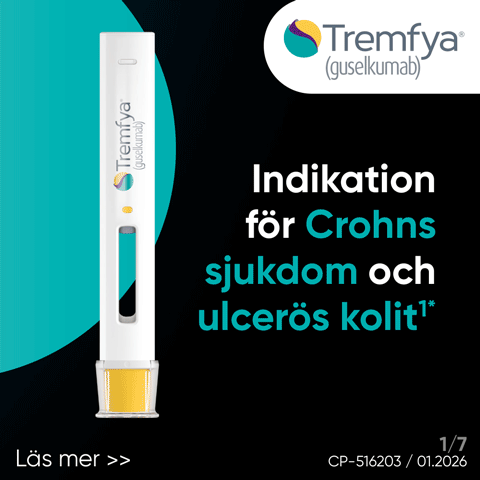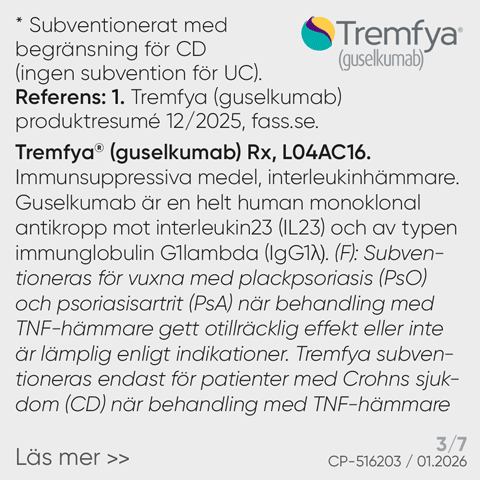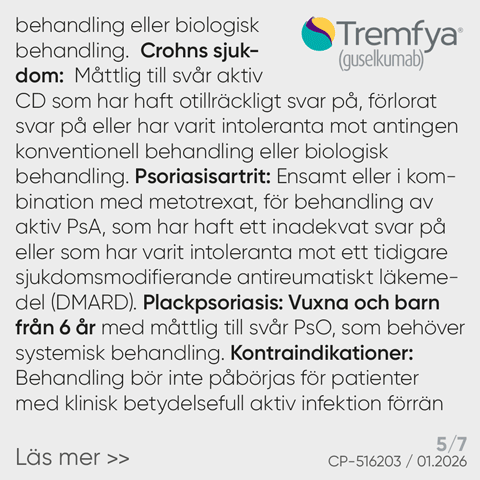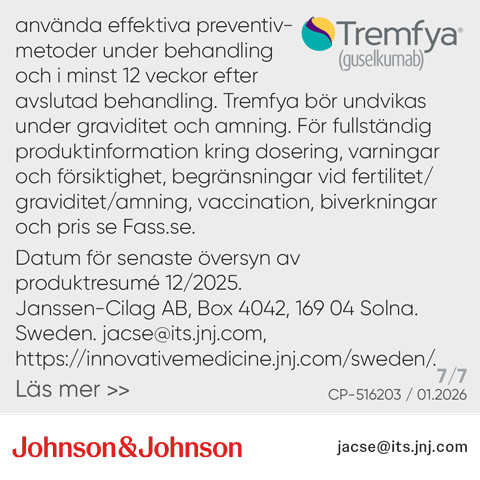
Pyzchiva® (ustekinumab) 45 mg och 90 mg injektionsvätska, lösning i förfylld spruta, 45 mg och 90 mg injektionsvätska, lösning i förfylld penna, 130 mg koncentrat till infusionsvätska, lösning. Rx, F (45 mg och 90 mg) /EF (130 mg) Immunsuppressiva medel, interleukinhämmare, ATC-kod: L04AC05. Indikationsområden: Plackpsoriasis: Behandling av måttlig till svår plackpsoriasis hos vuxna som inte svarat på andra systemiska behandlingar såsom ciklosporin, metotrexat (MXT) eller psoralen och ultraviolett A (PUVA), eller när intolerans eller kontraindikationer föreligger mot sådana behandlingar. Plackpsoriasis hos pediatriska patienter: Behandling av måttlig till svår plackpsoriasis hos barn och ungdomar från 6 år och äldre, som inte är adekvat kontrollerade med, eller intoleranta mot, andra systemiska behandlingar eller ljusterapier. Psoriasisartrit: Som monoterapi eller i kombination med MTX är avsett för behandling av aktiv psoriasisartrit hos vuxna när svaret på tidigare icke biologiska sjukdomsmodifierande antireumatiska läkemedel har varit otillräckligt. Kontraindikationer: Överkänslighet mot den aktiva substansen eller mot något hjälpämne. Kliniskt betydelsefull, aktiv infektion. Varningar och försiktighet: Ustekinumab kan potentiellt öka risken för infektioner och reaktivera latenta infektioner. Potential att öka risken för malignitet. Allvarliga överkänslighetsreaktioner har rapporterats, i vissa fall efter flera dagars användning. Anafylaxi och angioödem har inträffat. Fall av allergisk alveolit, eosinofil pneumoni och icke-infektiös organiserad pneumonihar rapporterats. Kardiovaskulära händelser inklusive hjärtinfarkt och stroke har observerats. Riskfaktorer för kardiovaskulär sjukdom ska bedömas regelbundet under behandling. Det rekommenderas att levande virala eller levande bakteriella vacciner inte ges samtidigt. Fall av lupusrelaterade tillstånd har rapporterats. Om lesioner uppstår, särskilt på solexponerade hudområden, eller om de åtföljs av artralgi, ska patienten omedelbart söka läkarvård. Fertilitet, graviditet och amning: Kvinnor i fertil ålder bör använda effektiva preventivmedel under behandlingen och i minst 15 veckor efter avslutad behandling. Som en säkerhetsåtgärd bör behandling helst undvikas under graviditet. Fördelarna för barnet med amning och fördelarna för kvinnan med behandling med ustekinumab måste vägas. Ombud med ansvar för läkemedelsinformationen i Sverige: Sandoz A/S, www.sandoz.se, mi.sweden@sandoz.com. Texten är baserad på produktresumé: 14.08.2025. För fullständig information om indikationer, priser, förpackningar och ytterligare information, se www.fass.se NR2508067558, 08/2025